Princípios da termodinâmica
Princípio zero: entrando em equilíbrio
O princípio básico sobre o qual a termodinâmica se assenta é : dado um sistema isolado
- envolto por uma fronteira completamente restritiva em relação à troca
de energia ou matéria - haverá um estado em particular, caracterizado
pela constância de todas as grandezas termodinâmicas mensuráveis
(temperatura, pressões parciais, volume das fases,
etc.), que, uma vez dado tempo suficiente para as transformações
necessárias ocorrerem, sempre será atingido. Os valores a serem
assumidos pelas grandezas no estado de equilíbrio encontram-se
univocamente determinados desde o estabelecimento da fronteira e do
sistema, dependendo estes, em sistemas simples, apenas do número e
natureza das partículas, do volume e da energia interna encerrados no
sistema. Tal estado final de equilíbrio do sistema é nomeado estado de equilibrio termodinâmico.
A rigor define-se temperatura apenas para o estado de equilíbrio
termodinâmico, não se definindo em princípio a mesma grandeza para
sistemas fora do equilíbrio.
O princípio zero ainda engloba o raciocínio de que, se dois sistemas A
e B - cada qual já em seu respectivo estado de equilíbrio - forem
colocados um a um em contato de forma adequada com um sistema C, e
verificar-se experimentalmente que estes mantiveram os respectivos
estados de equilíbrio originais, estes estarão não apenas em equilíbrio
com C mas também estarão em equilíbrio entre si, de forma que também
manterão seus respectivos estados de equilíbrio originais se colocados
em contato mediante fronteira semelhante. Considera-se para tal
geralmente uma fronteira não restritiva apenas quanto à troca de calor,
caso em que se fala em equilíbrio térmico . Tal princípio implica, pois: se a temperatura de A e B são iguais à
de C, as temperaturas de A e B serão também necessariamente iguais. Se a
fronteira não for restritiva quanto à troca de energia em qualquer de
suas formas - calor ou trabalho - mas o for ainda em relação à troca de
matéria, falar-se-á em equilíbrio térmico e mecânico. Neste caso, não
somente suas temperaturas mas também suas pressões serão iguais. Se a
fronteira for completamente irrestritiva, permitindo inclusive a troca
de matéria e reações químicas, falar-se-á em equilíbrio térmico,
mecânico e (eletro)químico, ou seja, em equilíbrio termodinâmico.
Este princípio básico - conhecido por razões cronológicas e
históricas como princípio zero da termodinâmica - é o que possibilita a
definição macroscópica de temperatura e também a construção de
termômetros.
Princípio primeiro: conservando a energia
Observação: a compreensão do que se segue exige o conhecimento das definições de: energia, energia interna, energia térmica, temperatura(absoluta), energia potencial, pressão, volume, calor e trabalho. Solicita-se a leitura dos artigos específicos caso estes conceitos não se mostrem familiares.
De acordo com o princípio da Conservação da Energia,
a energia não pode ser criada nem destruída, mas somente transformada
de uma espécie em outra. O primeiro princípio da termodinâmica
estabelece uma equivalência entre o trabalho e o calor trocados entre um sistema e seu meio exterior no que se refira à variação da energia interna do sistema.
Considere um sistema e sua vizinhança, em uma situação tal que uma
certa quantidade de calor Q tenha atravessado a fronteira comum aos dois
(devido à diferença de temperaturas entre ambos). Considere também que a
fronteira comum entre os sistemas se mova neste processo, implicando em
energia trocada na forma de trabalho entre ambos. Neste caso a variação
na energia interna do sistema em foco é expressa por:
A expressão acima representa analiticamente o primeiro princípio da termodinâmica, cujo enunciado pode ser:
" a variação da energia interna de um sistema é igual à diferença
entre o calor e o trabalho trocados pelo sistema com o meio exterior."
Considerando-se para fins ilustrativos um sistema composto por um gás com apenas movimentos translacionais (isso é, monoatômico) e sem interação potencial entre partículas, a variação de energia interna pode ser determinada por
onde n é o número de mols do gás, R é a constante dos gases, 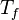 a temperatura final e
a temperatura final e  a temperatura inicial do gás.
a temperatura inicial do gás.
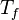 a temperatura final e
a temperatura final e  a temperatura inicial do gás.
a temperatura inicial do gás.
Repare que para um gás ideal a variação em sua energia interna está
associada apenas à variação em sua temperatura. Transformações
isotérmicas envolvendo um gás ideal implicam portanto que o trabalho W
realizado pelo sistema sobre a vizinhança iguala-se em módulo ao calor
que entra no sistema oriundo da vizinhança.
Para a aplicação do primeiro princípio de termodinâmica devem-se respeitar as seguintes convenções:
- Q > 0: calor é recebido pelo sistema oriundo de sua vizinhança.
- Q < 0: calor cedido pelo sistema à vizinhança.
- W > 0: volume do sistema aumenta; o sistema realiza trabalho sobre a vizinhança (cujo volume diminui).
- W < 0: volume do sistema diminui; o sistema recebe energia na forma de trabalho oriunda de sua vizinhança (cujo volume aumenta).
 > 0: a energia interna do sistema aumenta.
> 0: a energia interna do sistema aumenta. < 0: a energia interna do sistema diminui.
< 0: a energia interna do sistema diminui.
É muito comum associar-se de forma errônea o aumento da energia interna em um sistema a um aumento em sua temperatura.
Embora esta relação mostre-se verdadeira para a maioria dos sistemas,
ao rigor da análise esta associação não procede. Alguns exemplos bem
simples, como a combustão de vapor de gasolina e oxigênio em um cilindro
de automóvel - que por ser muito rápida, pode ser considerada um
processo adiabático - ou uma simples mistura de sal e gelo, mostram que não há uma relação estrita entre energia interna e temperatura, mas sim entre energia térmica e temperatura.
Na combustão do vapor de gasolina e oxigênio formam-se vapor de água e gás carbônico que, ao fim, estão em temperatura muito maior do que a temperatura dosreagentes. Contudo a energia interna do sistema não
varia. O que ocorre é a transformação de parte da energia potencial -
uma das parcelas que integram a energia interna - do sistema em energia
térmica, a outra parcela que a integra. Como o aumento na energia
térmica é inteiramente oriundo da diminuição da energia potencial
(energia química) do sistema, a energia interna permanece a mesma, e não
há variação na energia interna do sistema, mesmo observando-se um
enorme aumento em sua temperatura.
Caso contrário é observado em um sistema composto por gelo e sal
mantidos separados. Removendo-se a fronteira que os separa, a
temperatura da mistura salina que se forma cai drasticamente, contudo a
energia interna do sistema, assumido envolto por uma fronteira
completamente restritiva (um sistema isolado), permanece constante.
Parte da energia térmica é utilizada para romper-se as ligações iônicas
associada à forma cristalina do sal - liquefazendo a mistura - e
transformando-se por tal em energia potencial. O decréscimo na energia
térmica é contudo compensado pelo acréscimo na energia potencial, de
forma que a energia interna - conforme exigido pela fronteira restritiva
- não varia, embora a temperatura caia substancialmente.
Podemos dizer que a energia interna do sistema é uma função de estado
pois ela depende unicamente dos valores assumidos pelas variáveis de
estado do sistema, e não da forma como tais variáveis assumiram tais
valores. Em outras palavras, a energia interna de uma xícara de café
quente com mesma composição química, mesma concentração, mesma massa,
quando submetida à mesma pressão, volume e temperatura, será sempre a
mesma, independente de como se fez o café, ou se este foi feito agora,
ou requentado.
Repare que a energia interna é função apenas da temperatura somente
para casos especiais, como o caso do gás ideal. Para casos genéricos não
pode-se assumir tal conjectura como verdadeira. A energia interna pode
depender da pressão, do volume, e de qualquer outra grandeza
termodinâmica de forma explicita.
Quanto ao trabalho realizado pelo sistema sobre sua vizinhança, este pode ser facilmente determinado em transformações isobáricas- aquelas nas quais a pressão permanece constante - por:

onde V2 e V1 representam os volumes final e
inicial do sistema, respectivamente. Repare a convenção a origem da
convenção de sinais: quando o gás realiza trabalho sobre o meio -
expandindo-se contra a pressão imposta pelo mesmo e gastando parte de
sua energia interna para tal - o sinal do trabalho é positivo (volume
aumenta), o qual, substituído na expressão matemática do primeiro
princípio, implica um decréscimo da energia interna do sistema em
virtude do sinal negativo presente nesta última expressão.
Em casos mais complexos, o trabalho pode ser determinado através de
um diagrama de pressão x volume para a transformação sofrida. Este
corresponde à área sob a região determinada pelos estados inicial,
final, e pela curva associada (vide figuras abaixo).
Princípio segundo: uma passagem só de ida
A termodinâmica permite determinar a direção na qual vários processos físicos e químicos irão ocorrer espontaneamente, e as condições para que possam ser revertidos (reversibilidade). Permite também determinar quais processos podem ocorrer, e quais não podem (irreversibilidade). Também permite determinar as inter-relações entre as diversas propriedades de uma substância, a exemplo calor específico, coeficiente de dilatação volumétrica, compressibilidade,
e demais. Contudo ela não encerra em sua descrição macroscópica dados
relativos aos modelos da microestrutura da substância, e não é capaz de
fornecer detalhes dela partindo-se apenas das grandezas macroscópicas.
Contudo, uma vez que a estrutura microscópica do sistema seja
previamente conhecida, através do método da termodinâmica clássica e
estatística, as propriedades e o comportamento termodinâmicos do sistema
podem ser em princípio facilmente determinados.
Em sistemas adiabáticos determinados processos ocorrem em sentido
único, sendo impossível, sem violar-se a restrição adiabática imposta
pela barreira, regressar-se ao estado original. Associado à
irreversibilidade de tais processos tem-se a segunda lei da
termodinâmica: em processos adiabáticos, a entropia do sistema permanece constante ou aumenta, contudo nunca diminui. Se um
processo qualquer - geralmente processos bruscos, como a expansão livre
- implicar em aumento da entropia do sistema, o estado inicial - de
menor entropia - torna-se inacessível ao sistema sem violação da
restrição imposta. Após uma expansão livre não consegue-se mais retornar
às mesmas condições de pressão, volume e temperatura iniciais sem a
violação da fronteira adiabática do sistema.
A 2ª Lei da termodinâmica estabelece portanto uma seta para o tempo:
estabelece em essência a possibilidade de se definir com precisão uma
ordem cronológica para uma série de eventos relacionados. Estabelece que
energia cinética macroscópicamente mensurável pode sempre reduzir-se,
mediante trabalho, a calor, e desta forma acabar fazendo parte das
entranhas de um sistema termodinâmico - ou seja, da energia interna
deste - contudo o processo inverso jamais ocorre com rendimento de 100%.
Calor oriundo da energia interna de um sistema não pode ser totalmente
convertido em trabalho, e por tal jamais é completamente convertido em
energia cinética macroscopicamente mensurável. Decorre desta certamente
considerações estimulantes tanto de ordem filosóficas como de ordem
científica ligadas às implicações da mesma, a exemplo considerações
sobre a possível morte térmica do universo.

 ,
,
Nenhum comentário:
Postar um comentário